[摘要]:定量聚合酶链式反应(qPCR)是分子生物学的基础。它不仅仅是一种实验室技术,qPCR是研究和临床实践之间的桥梁。其理论基础指导实验设计,而其实际意义延伸至诊断、治疗以及生命科学、人类和兽医学、农业和法医学的研究进展。然而,由于与实验设计、执行、数据分析和不充分的报告细节相关的各种因素,qPCR数据的准确性、可靠性和再现性面临挑战。为了解决这些问题,用于公布定量实时PCR实验指南的最小信息(MIQE)提供了一套标准化的建议,描述了评估qPCR实验所需的基本信息。通过强调方法严谨的重要性,MIQE指南为提高许多已公布的qPCR结果的可信度、一致性和透明度做出了重大贡献。然而,与意识、资源和出版压力相关的重大挑战继续影响它们的一致应用。
1. 介绍
1998年《柳叶刀》发表了一项研究,暗示给予儿童的MMR疫苗与自闭症谱系障碍之间可能存在联系(Wakefield et al., 1998).那项研究,现在已经名誉扫地并被撤稿 (Murch et al., 2004),这引发了一场关于MMR疫苗安全性的旷日持久的公众辩论,并很快扩展为对一般疫苗接种的严重误解(O’ et al., 2004;Global AdvisoryCommittee on Vaccine Safety et al., 2009).即使在今天,英国仍没有常规的儿童疫苗接种计划达到世界卫生组织设定的95%的目标(Iacobucci, 2022).
将MMR疫苗与自闭症联系起来的核心主张之一是在自闭症儿童的胃肠道中明显检测到麻疹病毒。这种假定的联系是通过使用基于探针的RT-qPCR 分析比较健康和患病儿童的肠道组织样本(O’Hagen et al., 2000;Uhlmannet al., 2002),这似乎表明自闭症儿童中存在麻疹病毒(MV),但健康儿童中不存在。这些数据是支持疫苗与自闭症关联猜想的核心部分,也是唯一的科学证据。然而,英国高等法院在一起集体诉讼中下令对该研究进行独立调查,这引发了人们对研究准确性和可靠性的严重担忧.这些RT-qPCR结果(Bustin and Fitzgerald, 2013;Bustin, 2009),后来证明是不可复制的(Hornig et al., 2008).他们发现进行RT-qPCR检测的实验室没有遵循基本的科学实践:RT-qPCR工作流程的特点是缺乏适当的控制、方案存在严重错误、方法和结果报告不充分且具有误导性、持续存在且广泛的污染问题以及数据分析不恰当。因此,没有可信的证据表明本实验室研究的任何患者的胃肠道(或血液样本)中存在麻疹病毒基因组RNA或mRNA。因此,这些发现所建立的麻疹和MMR疫苗与自闭症之间的任何联系受到严重怀疑的(Bustin, 2008a).
可疑RT-qPCR的作用导致了这一争议。鲜明地提醒人们需要稳健的标准、严格的技术以及至关重要的报告透明度和全面性,并强调了有缺陷的实验设计、执行、分析和报告的现实后果。作为这一悲剧的直接后果和应对措施,制定了MIQE指南,旨在解决MMR案例所体现的问题(Bustin, 2010).他们认识到在qPCR实验中对标准化实践的广泛需求,并提供了一个全面的框架来可靠、完整地进行和报告qPCR实验透明地(Bustin et al., 2009).
2. qPCR 和 RT-qPCR
聚合酶链式反应(PCR)(Saiki et al., 1985;Mullis et al.,1986),定量PCR (qPCR)(Higuchi et al., 1992,1993;Heid et al.,1996)和逆转录聚合酶链反应(RT-PCR)(Rappolee et al., 1988;Gibson et al., 1996)可能是发明的最重要的分子技术。它们在阐明调控细胞过程的复杂机制方面发挥了关键作用,从细胞和组织特异性基因调控到指导细胞行为的复杂信号网络的相互作用(Deepak et al., 2007;Wagner, 2013).在诊断背景下,qPCR和RT-qPCR能够准确鉴定病原体以及检测疾病相关的遗传标记和表达谱(Kralik et al., 2017;Liu et al., 2023a;Martí et al., 2023).在临床环境中,qPCR有助于监测疾病进展、治疗反应和耐药菌株的出现。qPCR用于鉴定与药物代谢相关的遗传标记,从而有助于了解个体的基因如何影响其对药物的反应(Raso et al., 2020;Zhu et al., 2020).该技术也已成为法医学的支柱,允许从证据样本中详细评估核酸(Lee et al.,2014).其在缩小研究和临床实践之间差距方面的有效性强调了其在推进科学理解和患者护理方面的重要作用。
然而,与任何工具一样,基于qPCR的结果会受到适用条件的影响 (Murphy et al.,2009;Bustin et al., 2021;Johnson et al., 2013).这可能会使(RT)-qPCR诊断检测结果的解释有些复杂。尽管RT-qPCR检测本身很简单,但整个检测程序涉及多个检测前和检测后步骤,这些步骤与检测本身无关,但对检测的表观性能和结果解释有影响。这些阶段中的任何一个(或多个)都可能出错,并使测试看起来不如实际可靠(Bustin et al., 2005,2009;Bustin, 2004;Huggett et al., 2011;Bivinset al., 2021).
3. 使用qPCR和RT-qPCR相关的挑战
基于qPCR的实验的公布和解释与一些挑战和问题有关,这些挑战和问题会影响这些结果的可信度和再现性(Murphy et al.,2009;Nolan et al., 2006;Damond et al., 2008).与公布基于qPCR的结果相关的一些主要问题包括。
缺乏一致性:多样的分析设计、不明确的目标识别以及试剂和仪器的差异可能导致不可再现的结果,并阻碍跨研究的比较(Alemayehu et al., 2013;Taylor et al., 2014;Jarvis et al., 2016).
实验设计不足:设计不良的实验,包括引物设计欠佳、缺乏验证(包括特异性和效率测试)以及参考基因选择不当,可能导致结果有偏差或不可靠(Bustin et al., 2004a;Hui et al., 2013;Die et al., 2016).样本或试剂的交叉污染可能导致假阳性结果,特别是在高度敏感的qPCR检测中,因此必须包含适当的对照(Kwok et al., 1989;Mo¨gling et al., 2020;Huggett et al.,2020;Wernike et al., 2021).
样本质量和处理:样本质量、提取方法和储存条件的变化以及抑制因子的存在会给qPCR实验带来偏差(Viprey et al.,2007;Copois et al., 2007;Asare et al., 2008).正确的样本处理、质量分析和文档记录对于解决这些问题至关重要(Vermeulen et al., 2011;Becker et al., 2010;Dieet al., 2012).
数据分析问题: (Gra¨tz et al., 2022):透明地报告统计方法和结果至关重要(Karlen et al., 2007)作为不适当的数据分析方法,例如不正确或不一致的基线和阈值确定或缺乏对PCR效率的考虑(Livak et al., 2001;Pfaffl, 2001),会产生误导性的结果。不正确的标准化策略可能导致对基因表达数据的误解(Hellemans et al., 2014),因为标准化对于校正样品输入的变化或反应之间的效率差异是至关重要的(Vandesompele et al., 2002;Tricarico et al., 2002;Dheda et al., 2004,2005;Huggett et al., 2005).统计分析和报告不足可能导致对数据的错误解释(Skern et al., 2005;Hellemans et al., 2007).对qPCR数据的误解,特别是当报告了折叠变化而未考虑生物学相关性或未进行充分的统计分析时,可能会导致错误信息结论(D’haene et al., 2010a;Derveaux et al., 2010;D’haene et al.,2010b).
报告不完整:未提供全面文章中的实验细节阻碍了再现性(Jarviset al., 2016;Ioannidis et al., 2007).必须提供关键信息,如样本来源、目标加入详情、引物序列和数据分析细节,以便于验证。通常也无法访问原始数据,这使得其他人很难独立验证和再现这些发现(Alsheikh-Ali et al., 2011).
综上所述,很明显,qPCR结果的差异不仅仅是检测本身灵敏度高所导致,还会因缺乏标准化实验程序而加剧。鉴于这一背景,采用严格的标准不仅仅是科学严谨的问题,这也是维持qPCR在生物学研究中的地位和影响力的必要条件。
4. MIQE指南
2009年发布的《定量实时PCR实验指南的最低信息(MIQE)》是qPCR历史上的一个重要时刻(Bustin et al., 2009).它们是一个由qPCR相关从业人员组成的国际团体之间广泛和反复协作过程的产物,并通过对现有文献、实验数据和方法实践的仔细审查而形成。这一过程包括审查工作流程的每个关键方面,以确保所产生的指导方针既实用又普遍适用。它们并不具有规范性,而是提供了一个标准化的框架,该框架应具有足够的灵活性,以适应各种qPCR应用和实验设置(Bustin et al., 2010).一个普遍的主题是在报告所报告的结果所依据的方法时强调透明度、一致性和完整性(Bustin, 2000,2002a,2002b,2004,2005,2008b,2008c;Bustin et al., 2004b,2005,2013;Nolan et al., 2006;Huggett et al., 2005;Kubista et al., 2006;Fleigeet al., 2006a,2006b;Pfaffl et al., 2004;Stahlberg et al., 2004;Tichopadet al., 2009).
MIQE指南的范围是全面的,涵盖了qPCR实验的各个方面。概述的关键方面包括如下几点。
样本和生物材料:MIQE提倡对样本来源、RNA提取方法、核酸质量和完整性控制以及储存条件进行严格记录,承认这些变量会显著影响实验结果。
实验设计:精细的实验设计是MIQE的基石。这包括对引物和探针设计、优化和验证、PCR效率、检测极限、纳入对照和适当验证的指导参考基因,所有这些在产生可靠和可解释的结果中是至关重要的。
方案和仪器:MIQE指南强调了有关反向描述方案、热循环条件和所用qPCR方法的详细信息的重要性。
数据分析:MIQE为基线和阈值确定以及计算相对基因表达的方法学提供了明确的指南。这种对数据分析透明度的关注对于确保qPCR结果的稳健性至关重要。
5. MIQE的影响
5.1. 正面意义
MIQE指南对qPCR和基因表达分析的前景产生了重大影响,现在它们已成为最佳qPCR分析设计和透明报告的公认标准(Bustin et al., 2017a).它们的影响渗透到的各个方面研究应用和尽管“这种技术[qPCR]的挑战似乎正好落入许多科学家的盲点”(Marx,2013),他们对关键实验细节报告的重视无疑提高了qPCR数据的质量(Johnson et al.,2013;Lin et al., 2011;Lardiza´ et al., 2012;Reiter et al., 2011;Lanoixet al., 2012;Jacob et al., 2013).通过有助于公布更稳健和可再现的结果,该指南已成为保护qPCR实验的有效性、再现性和可信度的当务之急(Bustin, 2010;Taylor et al., 2010,2014,2019;Edmunds et al., 2014).该指南还促进了更有效的合作,并鼓励无缝共享数据集(Lefever et al., 2009;Ruijter et al., 2015).此外,MIQE还促使仪器制造商、试剂供应商和学术期刊纳入更严格的质量控制措施,进一步加强了这些指南的影响(Taylor et al., 2014).
符合MIQE的研究在临床诊断和生物标志物发现领域具有特殊的影响力(Gra¨tz et al., 2022).他们对严格指南的坚持激发了对其发现的信心,影响了分子诊断(Mussack et al., 2020;Elena-P´e et al.,2020;Bustin et al., 2020;Stolyar et al., 2021)并影响患者护理和治疗策略的发展(Kelly et al., 2012;Sanders et al., 2014;Dijkstra et al., 2014;Dooms et al., 2014).同样,该指南已应用于兽医药物的开发(Kuhar et al., 2013;Barnewall et al., 2022;Geraci-Yee et al.,2022)和农业(Montes-Borrego et al., 2011;Condori et al.,2011;Li et al., 2013;Pettengill et al., 2012)以及法医应用(Sauer et al., 2014,2017;Courts et al., 2019).
5.2. 利害关系
2013年,对1700多份报告qPCR数据的同行评审文章的调查显示,尽管引用MIQE的文章的报告标准有了显著提高,但引用MIQE的文章数量远远超过未引用的文章(Bustin et al., 2013).讽刺的是,报告的透明度与期刊的影响因素呈负相关。2014年发表的第二项研究考察了所用参考基因的数量以及它们是否经过验证,并得出结论,只有3%的文章甚至可以根据这些最低标准进行充分评估(Dijkstra et al., 2014).另一项针对阿拉伯世界生物医学研究绩效的研究于2014年发布,该研究还发现,遵守15项基本MIQE标准的情况较低(Abdel Nour et al., 2014).2017年发表的两项进一步研究发现,与大多数基于qPCR的文章相比,基本上同样缺乏必要信息(Bustin et al., 2017b;Bustin,2017).
Table 1描述了使用PubMed搜索“RT-qPCR”,并选择前50篇我可以访问其全文的文章。由于2023年的文章中只有一篇引用了MIQE指南(Riveroll et al., 2023),进行了第二次搜索,在搜索中添加了“MIQE”,并选择了两篇文章进行进一步分析。除了证明指南未被广泛引用之外,调查还显示,绝大多数论文仍未报告必要的实验细节,且未进行表达分析,而未考虑PCR效率或参考基因(RG)验证。相比之下,引用指南的三篇论文计算了PCR效率并验证了多个参考基因。值得注意的是,与2000年相比,未经验证的GAPDH仍然是最受欢迎的参考基因(Bustin, 2000).
需要重点强调的式这个错误不仅仅是作者的,大多数科学期刊在发表qPCR实验数据时并没有要求纳入MIQE指南,甚至不要求提供任何必要信息。在这种情况得到纠正之前,基于qPCR的研究发现的透明报告和总体可靠性不太可能得到改善,并且对该领域科学文献的质量和稳健性的有害影响将继续存在。
为什么要关注这两个参数(PCR效率和参考基因)?
5.2.1. 聚合酶链反应效率
PCR效率(表示为E)是一个重要参数,会显著影响相对定量的准确度。当使用△△Cq方法根据参考基因对目的基因的表达进行标准化时,PCR效率知识尤为相关。该方法报告了处理样本和对照样本之间基因表达的相对倍数变化。它包括比较目标样本和对照样本之间靶基因(TG)的阈值循环(△Cq)值的差异,两者均标准化为参考基因(目标样本中的△cqTG-RG - 对照样本中的△cqTG-RG)。然后,倍数变化表示为2-△△Cq,其中大于1的值表示较高的基因表达,小于1的值表示较低的基因表达。然而,这假定扩增效率相等,而实际上PCR效率差异很大,可能低至约60%(Tichopad et al., 2003;Pfaffl and Bustin, 2004)至80%(Ramakerset al., 2003).至关重要的是,这将导致不准确的结果,因为PCR扩增的指数性质意味着效率差异会转化为对基因表达水平的误导性解释(Rao et al., 2013).这是因为当归一化时,相对于参考基因,3%的qPCR效率的小差异将在30个循环后产生超过200%的错误计算的表达比率差异,而具有5%和10%的差异(Pfaffl and Dorak, 2006). 表达比率差异分别显著增加到超过400%和1700%,值得注意的是,这一显而易见的事实被广泛忽视,这可能是因为最初的文章假定PCR反应的效率接近100%(Livak et al., 2001),大多数文章采用了100% PCR效率模型用于所有qPCR分析。尽管最初的文章明确指出,只有当目标和参考的扩增效率大致相等时,△△Cq计算才有效,最近的后续文章强调了测定每种分析的效率的重要性(Schmittgenet al., 2008).20多年前,在一份开创性的qPCR文章中承认并论述了校正靶基因和参考基因之间效率差异的重要性(Pfaffl, 2001)。因此,效率不仅是一个技术细节,也是基于qPCR的表达分析的一个重要方面,确保报告的基因表达值更准确地反映生物学现实。值得一提的另一个重要问题是,不同仪器和实验条件下的PCR效率可能不同。因此,即使公布的PCR效率在不同的实验室使用经过修改的实验装置时也需要重新验证。有几种计算PCR效率的方法。
PCR效率的经验验证最常涉及通过扩增已知浓度的系列稀释的靶DNA生成标准曲线,理想情况下使用数字PCR (dPCR)测定。通过绘制初始DNA量的对数与相应的Cq值,生成标准曲线,标准曲线的斜率提供了qPCR效率(Pfaffl, 2001;Ginzinger, 2002).100%的效率对应于标准曲线中的斜率3.32。这种方法的主要缺点是需要大量的资源和时间,不适合分析大量的目标。
替代方法通过将指数数学应用于对数线性区域来确定扩增效率,使用线性(Ramakers et al., 2003;Gentle et al., 2001;Liuet al., 2002a)或非线性回归(Bar et al., 2003;Zhao et al.,2005).一种这样的方法是LinRegPCR,它在处理扩增曲线中表现出明显线性相位的数据时是稳健的(Ruijter et al., 2009).它通过在扩增曲线的线性相位(代表指数扩增的初始相位)上拟合一条直线,直接计算PCR效率。然后,它使用线性回归分析来确定最合适的斜率,代表指数放大。
对数-线性反映恒定扩增效率的假设已经受到挑战(Rutledge et al., 2008a) 并导致探索s形模型以将非线性回归曲线算法拟合到实验数据。(Liu et al., 2002a,2002b;Rutledge et al., 2003,2008b;Rutledge, 2004). 这些研究旨在通过考虑诸如背景荧光、平台阶段和曲线形状等因素来更准确地描述扩增曲线,以便计算PCR效率和估计初始靶拷贝数。然而,他们面临着很大的局限性,因为他们可能会过度拟合数据,数据复杂,并且依赖于对扩增曲线形状的假设。这些缺点最终影响了效率估计的可靠性(Swillenset al., 2008) 因此导致s形模型在很大程度上被取代。
MIQE指南强调的重要原则是,必须计算PCR效率,并将此信息纳入任何基因表达谱报告中。
5.2.2. 参考基因验证
基于qPCR的数据的适当标准化是获得有生物学意义的结果的必要步骤(Huggett et al., 2005).为了实现这一点,使用参考基因已经成为普遍的方法(Hellemans et al., 2014).不幸的是,2015年的一项研究显示,大多数已发表的qPCR数据是基于使用单个未验证的参考基因(Chapman et al., 2015).GAPDH或β-actin仍然是长期受欢迎的药物,尽管在很久以前和以后的许多时间里已经证明是不可靠的(Dheda et al., 2004,2005;Bustin,2000;Bustin et al., 2000;Suzuki et al., 2000;Selvey et al., 2001;Barberet al., 2005). Table 1 中的分析表明这在2023年没有改变。
表1. 对50种近期基于RT-qPCR的文章进行分析,以了解是否包含一些重要的技术信息。
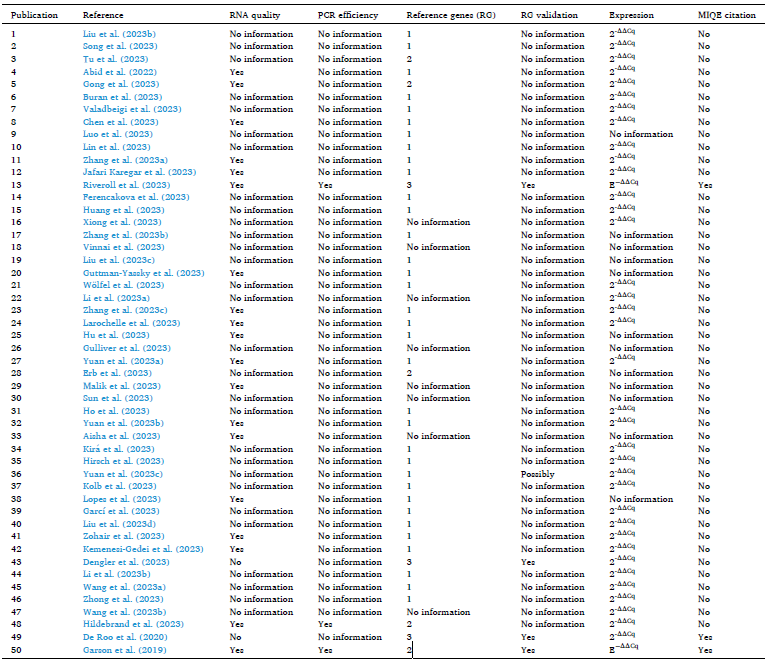
长期以来,人们一直不鼓励使用单个参考基因,因为它可能导致显著倍数的错误标准化(Tricarico et al., 2002)依赖未验证的参考基因(Dheda et al., 2005).精细选择合适的参考基因的关键要求背后的关键原因在于固有的生物和技术可变性,这是基于qPCR的分析的特征。细胞类型、组织来源、实验处理、疾病状态或样本采集的特定时间等因素会显著影响基因表达模式,包括参考基因的表达稳定性。整个工作流程固有的技术可变性加剧了这种可变性,例如纯化样本将包含不同量的核酸这一不可避免的事实。解决这一问题的一个重大进展是在另一份开创性的qPCR文章中引入了geNORM(Vandesompeleet al., 2002).该软件工具提供了第一条途径,可通过经验确定最稳定的RG以及计算可靠归一化因子所需的最小数量。其建议是使用多个参考基因(通常在3至5个之间),以提供更全面和更具代表性的正常化策略。这种多基因方法减轻了个体基因可变性的影响,从而产生了更准确的标准化过程。GeNORM通过定义两个描述参考基因稳定性的参数:M和V. A .下限M值表示更好的稳定性,V值表示精确的基因表达正常化所需的参考基因的最佳数目。随后,出现了几种其他算法来评估潜在参考基因的稳定性并识别最合适的标准化候选基因(Pfaffl et al.,2004;Andersen et al., 2004;Heckmann et al., 2011;Curis et al., 2019).值得注意的是,由于这些方法对mRNA表达具有特异性,因此开发了一种单独的方法来确保mirna的准确标准化(Mestdagh et al., 2009).
虽然MIQE指南已经解决了其中的许多问题,但仍存在未决问题。miRNAs作为潜在的临床应用生物标志物的出现(Faraldi et al., 2018)需要一种公认的通用方法来使临床样本中的游离循环miRNAs水平正常化。长非编码RNA越来越被认为在正常以及癌细胞生理活动中具有重要作用(Zhu et al., 2013;Goyal et al., 2021),但如何以有意义的方式表达表达水平的问题仍然不清楚。细胞外囊泡重要性的增加也要求标准化标准化方法,以便对不同研究产生的结果进行有意义的比较(Occhipinti et al.,2016;Liu et al., 2015).这些问题将在即将发布的MIQE 2.0指南中讨论,该指南目前正在编写中。
5.2.3. 有助于qPCR分析设计和分析的工具
除了Multid的Genex等商业软件之外,一些免费和开放获取的工具已成为处理和分析qPCR数据的宝贵资源,为研究人员提供了增强数据处理和解释的可访问平台。
SATqPCR提供了用户友好的界面和用于定量聚合酶链反应数据标准化、可视化和统计分析的各种功能,在综合数据处理方面增强用户的能(Rancurel et al.,2019).
Auto-qPCR通过自动测定PCR效率、Cq值和基因表达计算来简化分析过程,从而促进高效和准确的数据处理(Maussion et al., 2021).
Q-PCR为分析qPCR数据提供了一个通用工具包,提供了引物设计、扩增曲线分析和定量循环测定的功能(Pabinger et al., 2009).
PIPE-T以其综合管道而闻名,该管道集成了各种分析步骤,包括质量控制、标准化和差异基因表达分析,促进了qPCR数据处理的系统和高效方法(Zanardi et al., 2019).
这些可自由使用的工具通过提供与MIQE指南中强调的几个关键方面一致并有助于这些方面的各种功能,共同推动了qPCR分析。
5.2.4. 这在2023年意味着什么?
这强烈表明,Table 1中文章报告的许多结论以及基于qPCR的文章通常可能无效。同样明显的是,很少有作者将MIQE指南纳入他们的工作流程或报告实践中。
很明显,这种对这些指导方针缺乏一致的遵守令人担忧。有几个因素导致了这种情况。
缺乏意识和惰性:尽管MIQE指南已得到广泛认可,但许多研究人员,尤其是该领域的新手或仅大致熟悉该技术基础知识的研究人员,不仅没有意识到它们,甚至没有意识到与开展和解释基于qPCR的实验相关的挑战。此外,研究人员可能对变化有抵抗力,尤其是如果他们多年来一直使用特定的方案和参考基因。显然,必须做出更多努力,通过讲习班、会议和教育方案提高认识并提供实验设计和数据分析方面的培训。
不遵守MIQE指南没有明显的缺点,导致大多数研究人员忽略了它们。快速出版的压力,尤其是在高度竞争的领域,可能也是作者牺牲综合方法报道来加速出版过程的一个因素。大多数期刊在对作者的指导中没有提到(更不用说强调)MIQE指南,从而没有起到积极的作用,并且评论者通常不够专业,无法识别实验方案、数据分析和解释中的基本缺陷。如果供资机构考虑执行将遵守既定准则作为赠款条件的政策,这也可能有所帮助,从而为遵守政策创造更强有力的激励。
6. 数据交换
虽然MIQE指南提供了一套稳健的建议来标准化qPCR数据报告,但并未提供存储、交换和解释qPCR数据的标准方法。实时PCR数据标记语言(RDML),作为基于可扩展标记语言(XML)的格式(Lefever et al., 2009),旨在通过提供一种与仪器无关的结构化格式来存储和交换与MIQE原则无缝一致的qPCR数据,从而实现这一目标。它的实施有几个好处。
以RDML格式存储数据简化了qPCR数据的长期保存,这对分子医学和诊断学的纵向研究很重要。研究人员可以随时间访问和解释信息,保持数据的完整性。
RDML通过整合来自各种仪器和平台的定量聚合酶链反应数据促进合作。它降低了数据传输过程中的数据丢失风险,并且可以与第三方分析软件集成,促进互操作性。
通过提供一致的报告格式,RDML简化了实验再现、结果验证和新研究的开发。
RDML与自动化的兼容性使其成为基因组学和转录组学、数据流数据处理和分析的高通量实验的理想之选。
RDML的进步,以最初的挑战和随后的更新和延期为标志(Lefever et al., 2009;Ruijter et al., 2015;Magnoet al., 2017;Pabinger et al., 2014;Untergasser et al., 2021),表明在数据兼容性、互操作性、可再现性和长期数据保存方面取得了重大进展。它的最终采用将极大地促进依赖于qPCR数据的分子医学、不可知论及相关领域的进展。
7. MIQE对数字MIQE (dMIQE)指南的影响
数字聚合酶链反应(dPCR)的出现(Vogelstein et al., 1999)代表了核酸定量的重大进步,提供了传统qPCR方法的替代方法(Pohl et al., 2004;Sanders et al., 2011)以及作为补充技术(Whale et al., 2021).dPCR能够将样本分成数千个独立反应,为核酸定量带来了更高的精确度和灵敏度(Pradervandet al., 2010;Huggett et al., 2013a;Gavina et al., 2023).然而,与qPCR一样,显然需要标准化和报告指南来确保dPCR结果的可靠性和可比性(Sanderset al., 2013).
借鉴MIQE指南,dMIQE指南旨在为进行dPCR实验和报告其结果提供一个结构化的框架(Huggett et al., 2013b;dMIQE et al., 2020).它们以MIQE的基本原则为基础,同时结合了与数字PCR相关的具体考虑。其中包括样本划分、数据分析(特别强调检测和定量的限制)等问题。与MIQE一样,dMIQE指南旨在确保使用该技术的研究人员在实验设计、执行和报告方面遵守严格的标准,从而促进qPCR和dPCR实验之间的一致性和可比性(Huggett et al.,2015).dMIQE指南对dPCR领域产生了重大影响,在同行评审文献中引用了近1000次,与MIQE一样,dMIQE的采用也对仪器制造商、试剂供应商和科学期刊产生了影响,促进了dPCR作为一种稳健和标准化定量技术的持续发展。
8. 总结和结论
基于qPCR的方法是分子研究和诊断中不可或缺的工具,有许多应用。然而,这些方法的可信度和基于qPCR结果的结论的有效性取决于严格遵守标准化方案以及数据和分析方法的全面报告。MIQE指南在提高该领域的透明度和可靠性方面发挥了重要作用。他们的影响超出了实验室的范围,塑造了基因表达分析的格局,增强了其在基础研究和临床应用中的可信度。然而,尽管MIQE在提高qPCR和RT-qPCR实验的质量和透明度方面取得了显著进展,但与意识、资源可用性、培训、对变化的抵制以及不一致的实施相关的主要挑战阻碍了它们的普遍应用。随着该领域的不断发展,来自科学界、期刊和资助机构需要进一步促进它们的采用。通过务实地应对这些挑战,我们可以确保基于qPCR的数据在科学文章中的可信度,从而为对研究成果的信任奠定基础。

原文如下:
Bustin SA. Improving the quality of quantitative polymerase chain reaction experiments: 15 years of MIQE. Mol Aspects Med. 2024 Jan 29;96:101249. doi: 10.1016/j.mam.2024.101249. Epub ahead of print. PMID: 38290180.
(1).png)
工厂地址: 江苏如东珠江路888号生命健康园20号楼
电话:+86-21-68030217/33782006/33782046
邮箱:market@toroivd.com


